I LAPSO
- Transformacion de unidades de longitud, peso, volumen y grados celsium, farenheit y kelvin:
Para convertir las unidades de longitud, es importante conocer su simbología y equivalencias:
km = kilómetro
hm = hectómetro
dam = decámetro
m = metro
dm = decímetro
cm = centímetro
mm = milímetro
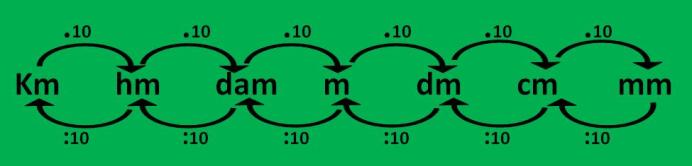
Ahora, observa el siguiente gráfico:
Además debes saber :
*Las unidades mayores se ubican hacia la izquierda y las unidades
menores, a la derecha. Por tanto, si quiero convertir m a km, estaría
convirtiendo una unidad menor a una unidad mayor, también si convierto
mm a dm, estaría convirtiendo una unidad menor a otra mayor. Por el
contrario, si convierto km a dam, estaría convirtiendo una unidad mayor
a otra menor, también, si convierto m a mm, estaría convirtiendo una
unidad mayor a otra menor.
Conozcamos algunas equivalencias:
1 m = 10 dm 1 km = 1000 m
1 m = 100 cm 1 hm = 100 m
1 m = 1000 mm 1 dam = 10 m
Procedimiento para convertir unidades de longitud:
1.Ubica la unidad que vas a convertir y la unidad convertida en el gráfico:
Convertir 23 m a mm
Cuando conviertes 23 m a mm, estás convirtiendo una unidad mayor a
otra menor, observa que el único camino que podemos usar son las flechas
de arriba, estas me indican que se multiplica .10 .10 .10 esto es
igual a 1000.
2. Por tanto 23 m a mm será: 23.1000 = 23000 mm
3. Podemos concluir, que cuando convertimos una unidad mayor a otra menor, se multiplica.
Unidad de medida de volúmen
La medida fundamental para medir volúmenes es el metro cúbico.
Otras unidades de volúmenes son:
| kilómetro cúbico |
km3 |
1 000 000 000 m3 |
| hectómetro cúbico |
hm3 |
1 000 000m3 |
| decámetro cúbico |
dam3 |
1 000 m3 |
| metro cúbico |
m3 |
1 m3 |
| decímetro cúbico |
dm3 |
0.001 m3 |
| centímetro cúbico |
cm3 |
0.000001 m3 |
| milímetro cúbico |
mm3 |
0.000000001 m3 |
¿Cómo convertir las unidades de volúmen en una más grande o más pequeña? Equivalencia
Observamos que desde los submúltiplos, en la parte inferior, hasta los
múltiplos, en la parte superior, cada unidad vale 1000 más que la
anterior.
Por lo tanto, el problema de convertir unas unidades en otras se reduce
a multiplicar o dividir por la unidad seguida de tantos tríos de ceros
como lugares haya entre ellas.
Ejemplos: Pasar 1.36 Hm3 a m3
Tenemos que multiplicar, porque el Hm3 es mayor que el m3; por la
unidad seguida de seis ceros, ya que hay dos lugares entre ambos.
1.36 · 1 000 000 = 1 360 000 m3
- Pasar 15 000 mm3 a cm3
Tenemos que dividir, porque el mm3 es menor que el cm3 , por la unidad seguida de tres ceros, ya que hay un lugar entre ambos.
- Transformaciones de Peso (g): Las transformaciones de unidades de gramo (g) o peso en general, poseen la misma mecánica que las transformaciones de longitud, sin embargo, las unidades que se trabajaran serán diferentes de la siguiente manera:
 |
| Escala de Peso |
- Kilogramo: KG (1000 g).
- Hectogramo: HG (100 g).
- Decagramo: DG (10 g).
- Gramo: Unidad Base g.
- Decigramo: dg (0.1 g).
- Centigramo: cg (0.01 g).
- Miligramo: mg (0.001g).
- Transformaciones de Temperatura (Grados Celsius, Farenheit y Kelvin)
Existen diferentes medidas de temperaturas alrededor del mundo, aunque las principales y más comunes son la Celsius, Farenheit y Kelvin, para realizar conversiones de temperatura entre ellas se deben seguir ciertos procesos matemáticos:
-
Para transformar Celsius a Kelvin: Se toma la cantidad de grados Celsius y se le suma 273,15.
- Para transformar de Kelvin a Celsius: Se toma la cantidad de grados Kelvin y se le resta 273,15.
- Para transformar Celsius a Farenheit: Se toma la cantidad de grados Celsius, se multiplica por 9, luego se divide entre 5, y por último se le suma 32.
- Para transformar Farenheit a Celsius: Se toma la cantidad de grados Farenheit, se multiplica por 5, luego se divide entre 9 y por último se le resta 32.
- Para transformar Kelvin a Farenheit: Se toma la cantidad de grados Kelvin, se le transforma a Celsius (-273,15) y después se le transforma a Farenheit (x9; /5; +32).
- Para transformar Farenheit a Kelvin: Se toma la cantidad de grados Farenheit, se le transforma a Celsius (x5 /9 -32) y después se le transforma a Kelvin (+273,15).
- La Química, Importancia y sus Ramas:
- La química cubre un campo de estudios bastante amplio, por lo que en la práctica se estudia cada tema de manera particular. Las seis principales y más estudiadas ramas de la química son:
- Química inorgánica: síntesis y estudio de las propiedades eléctricas, magnéticas y ópticas de los compuestos formados por átomos que no sean de carbono (aunque con algunas excepciones). Trata especialmente los nuevos compuestos con metales de transición, los ácidos y las bases, entre otros compuestos.
- Química orgánica: Síntesis y estudio de los compuestos que se basan en cadenas de carbono.
- Bioquímica: estudia las reacciones químicas en los seres vivos, estudia el organismo y los seres vivos. Bioquímica es el estudio de las sustancias químicas, las reacciones químicas y las interacciones químicas que tienen lugar en los organismos vivos. Bioquímica y la química orgánica están estrechamente relacionados, como en la química médica o neuroquímica. Bioquímica también se asocia con la biología molecular y la genética.
- Química física: también conocidas como fisicoquímica, estudia los fundamentos y bases físicas de los sistemas y procesos químicos. En particular, son de interés para el químico físico los aspectos energéticos y dinámicos de tales sistemas y procesos. Entre sus áreas de estudio más importantes se incluyen la termodinámica química, la cinética química, la electroquímica, la mecánica estadística y la espectroscopia. Usualmente se la asocia también con la química cuántica y la química teórica.
- Química industrial: Estudia los métodos de producción de reactivos químicos en cantidades elevadas, de la manera económicamente más beneficiosa. En la actualidad también intenta aunar sus intereses iníciales, con un bajo daño al medio ambiente.
- Química analítica: estudia los métodos de detección (identificación) y cuantificación (determinación) de una sustancia en una muestra. Se subdivide en Cuantitativa y Cualitativa.
- Además, existen otras subdisciplinas de la química que no destacan tanto como las principales como la geoquímica, la petroquímica, la nanoquímica, etc.
- Importancia de la Química: • Cocina
La química explica cómo se desarrollan los cambios de los alimentos a medida que se preparan, cómo se pudren, cómo conservar los alimentos, cómo su cuerpo utiliza los alimentos que consume, y cómo interactúan los ingredientes para hacer la comida.
• Limpieza
Parte de la importancia de la química es que nos explica cómo es el funcionamiento de la limpieza. La química se utiliza para ayudar a decidir lo que es más limpio para platos, lavandería, usted mismo, y su hogar. Se utiliza la química al utilizar desinfectantes y blanqueadores, pero también como el jabón y el agua.
• Medicina
Es necesario comprender la química básica para que pueda entender cómo los medicamentos, las vitaminas y también los suplementos nos pueden ayudar o perjudicar a la salud. Parte de la importancia de la química en la medicina o en la salud radica en desarrollar y probar nuevos tratamientos médicos y medicinas.
• Cuestiones ambientales
La química está en el corazón de los problemas ambientales. ¿Qué hace que un producto químico de un nutriente y otro producto químico sean contaminantes? ¿Cómo se puede limpiar nuestro medio ambiente sin dañarlo aún más? ¿Qué procesos se producen en las cosas que usted necesita sin dañar el medio ambiente?
Todo es química. Utilizamos productos químicos cada día y realizamos reacciones químicas sin pensar mucho en ello. Es importante ya que todo lo que haces acaba siendo química. Incluso su cuerpo está hecho de sustancias químicas. Muchas reacciones químicas ocurren cuando usted come, respira, camina, o simplemente mientras pasa su tiempo leyendo. Los materiales están hechos de productos químicos, por lo que la química adquiere una importancia radical ya que es el estudio de todo.
- Masa, Volumen y Densidad:
Las diferentes partículas que existen en la naturaleza están conformadas por partículas (átomos, iones o moléculas) que según las condiciones de presión y temperatura a las que se encuentran definirán el estado de agregación molecular (sólido, liquido o gaseoso) y una condición muy característica.
Para caracterizar el estado tan singular de la sustancia, se emplea la propiedad física intensiva denominada densidad (ρ), que nos indicara la cantidad de masa del cuerpo material contenido en un volumen definido de ella.
Por lo tanto la masa y el volumen de una sustancia la podemos evaluar así:
> masa: m = ρ . V
> Volumen: V = m / ρ
Unidades: Las unidades en la que puede estar la densidad son:

Recordemos las medidas de peso y de volumen para estos ejercicios (consultar arriba para reforzar).
II LAPSO
- Soluciones: Las soluciones son sistemas homogéneos formados básicamente por dos componentes. Solvente y Soluto. El segundo se encuentra en menor proporción. La masa total de la solución es la suma de la masa de soluto mas la masa de solvente.
Las soluciones químicas pueden tener cualquier estado físico. Las más comunes son las líquidas, en donde el soluto es un sólido agregado al solvente líquido. Generalmente agua en la mayoría de los ejemplos. También hay soluciones gaseosas, o de gases en líquidos, como el oxígeno en agua. Las aleaciones son un ejemplo de soluciones de sólidos en sólidos.
La capacidad que tiene un soluto de disolverse en un solvente depende mucho de la temperatura y de las propiedades químicas de ambos. Por ejemplo, los solventes polares como el agua y el alcohol, están preparados para disolver a solutos iónicos como la mayoría de los compuestos inorgánicos, sales, óxidos, hidróxidos. Pero no disolverán a sustancias como el aceite. Pero este si podrá disolverse en otros solventes como los solventes orgánicos no polares.
Concentración: La concentración es la relación que existe entre la cantidad de soluto y la cantidad de solución o de solvente. Esta relación se puede expresar de muchas formas distintas. Una de ellas se refiere a los porcentajes. Porcentaje masa en masa o peso en peso, (%m/m):Es la cantidad en gramos de soluto por cada 100 gramos de solución. Ej: Una solución 12% m/m tiene 12 gramos de soluto en 100 gramos de solución.
Como formula, podemos expresar esta relación así: %m/m = x 100
Porcentaje masa en volumen (%m/v): Es la cantidad en gramos de soluto por cada 100 ml de solución. Aquí como se observa se combina el volumen y la masa. Ej: Una solución que es 8% m/v tiene 8 gramos de soluto en 100 ml de solución. Fórmula: % m/v = x 100
Porcentaje volumen en volumen (%v/v): Es la cantidad de mililitros o centímetros cúbicos que hay en 100 mililitros o centímetros cúbicos de solución. Ej: Una solución 16% v/v tiene 16 ml de soluto por 100 ml de solución. Fórmula: % v/v = x 100
Otras formas son la Molaridad, la Normalidad y la Molalidad.
Es bueno recordad antes el concepto de mol. El mol de una sustancia es el peso molecular de esa sustancia expresada en gramos. Estos datos se obtienen de la tabla periódica de los elementos. Sumando las masas de los elementos se obtiene la masa de la sustancia en cuestión.
Molaridad: Es la cantidad de moles de soluto por cada litro de solución. Como fórmula: M = n/V. M = M: Molaridad. n: Número de moles de soluto. V: Volumen de solución expresado en litros.
Normalidad: Es la cantidad de equivalentes químicos de soluto por cada litro de solución. Como fórmula: N = n eq/V. N = Normalidad. n eq. : Número de equivalentes del soluto. V: Volumen de la solución en litros.
Molalidad: Es la cantidad de moles de soluto por cada 1000 gramos de solvente. En fórmula: m = n/kgs solvente. m = Molalidad. n: Número de moles de soluto por Kg = 1000 gramos de solvente o 1 kg de solvente.
- Mezclas: Una mezcla es una sustancia que está formada por varios componentes (dos o más), que no pierden sus propiedades y características por el hecho de mezclarse ya que no se produce una reacción química entre ellos. ejemplos de mezclas pueden ser una ensalada, agua salada (agua y sal), azúcar y sal, etc.
-Tipos de Mezclas:
- Mezclas homogéneas : Aquellas mezclas que sus componentes no se pueden diferenciar a simple vista. Las mezclas homogéneas de líquidos se conocen con el nombre de disoluciones y están constituidas por un soluto y un disolvente, siendo el primero el que se encuentra en menor proporción y además suele ser el líquido. Por ejemplo, el agua mezclada con sales minerales o con azúcar, el agua sería el disolvente y el azúcar el soluto.
- Mezclas Heterogéneas : Aquellas mezclas en las que sus componentes se pueden diferenciar a simple vista.
- Métodos de Separación de Mezclas
Las mezclas vienen en muchas formas y fases. La mayoría de ellas se pueden separar de nuevo en sus componentes originales. El tipo de método de separación depende del tipo de mezcla que sea. A continuación presentamos algunos métodos de separación de mezclas más comunes. Al final tienes una imagen resumen de los métodos que explicamos. Mira la imagen cada vez que leas un método para entenderlo mejor. Las técnicas que se utilizan para la separación de mezclas son:
- Tamización: esta puede ser utilizada para la separación de mezclas sólidas, compuestas con granos de diversos tamaños. Lo que se hace es hacer pasar a la mezcla por varios tamices (tabla con agujeros de pequeño tamaño).
- Filtración: esta técnica permite la separación de aquellas mezclas que están compuestas por líquidos y sólidos no solubles, es decir que los sólidos no se disuelven en el líquido. Por ejemplo el azúcar se disuelve con el agua, pero si echamos arena esta no se disuelve, es decir no es soluble. Para separar estas mezclas, se utiliza un embudo con un papel de filtro en su interior. Lo que se hace pasar a la mezcla por ellos.
- Separación magnética: esta técnica sólo es útil a la hora de separar sustancias con propiedades magnéticas de aquellas que no las poseen. Para esto, se utilizan imanes que atraen a las sustancias magnéticas y así se logra separarlas de las que no lo son.
- Decantación: Decantar es dejar reposar la mezcla. Esta técnica sirve para la separación de líquidos que tienen diferentes densidades y no son solubles entre sí. En esta técnica se requiere un embudo de decantación que contiene una llave para la regulación del líquido. Una vez decantada la mezcla (dejar en reposo) el elemento más denso irá al fondo y por medio del embudo de decantación, cuando se abre la llave se permite el paso del líquido más denso hacia un recipiente ubicado en la base, quedando el líquido con menor densidad en la parte de arriba del embudo.
- Cristalización y precipitación: esta permite la separación de un soluto sólido de que se encuentra disuelto en un disolvente. Se calienta la disolución para concentrarla, luego se la filtra y se la coloca en un cristalizador hasta que se evapore el líquido, quedando el sólido en forma de cristal.
- Destilación: es útil para la separación de líquidos que son solubles entre sí. Lo que se hace es hervirlos y, como esto lo hacen a distintas temperaturas de ebullición, se toman sus vapores por un tubo para luego pasarlo al estado líquido nuevamente. Esto es posible gracias a que hierven en distintos tiempos. Por ejemplo imaginemos agua y sal. El agua hierve a 100ºC, si calentamos la mezcla a esa temperatura lo que se evapora será el agua, la sal no se evaporará (tiene temperatura de ebullición más alta). Si recogemos el vapor tenemos el agua separada de la sal.
III LAPSO
- Nomenclatura Química: Nomenclatura en química inorgánica
Los compuestos inorgánicos se clasifican según la función química que contengan y por el número de elementos químicos que los forman, con reglas de nomenclatura particulares para cada grupo. Una función química es la tendencia de una sustancia a reaccionar de manera semejante en presencia de otra. Por ejemplo, los compuestos ácidos tienen propiedades característica de la función ácido, debido a que todos ellos tienen el ion H+1 ; y las bases tienen propiedades características de este grupo debido al ion OH-1 presente en estas moléculas. Debemos recordar aquí que las principales funciones químicas son: óxidos, bases, ácidos y sales.
Actualmente se aceptan tres sistemas o subsistemas de nomenclatura, estos son:
- El Sistema de Nomenclatura Estequiométrica o Sistemático.
- El Sistema de Nomenclatura Funcional, Clásico o Tradicional.
- El Sistema de Nomenclatura Stock.
Estos tres sistemas nombran a casi todos los compuestos inorgánicos, siendo la nomenclatura tradicional la más extensa. Algunas reglas para la nomenclatura inorgánica:
Se escribe siempre en primer lugar el símbolo del elemento o radical menos electronegativo (menor capacidad de atraer electrones) y a continuación el del elemento o radical más electronegativo (mayor capacidad de atraer electrones). Pero se nombran en orden inverso a este orden.
Por ejemplo, CrBr 3 = tribromuro de cromo; CO = monóxido de carbono
Se intercambian las valencias de los elementos o los radicales, colocándolas en forma de subíndices. Estos subíndices se simplifican, si se puede, teniendo en cuenta que deben ser números enteros y que el 1 no se escribe.
En los ejemplos anteriores: CrBr 3
El cromo está actuando con valencia 3 (Cr +3 ) y el bromo lo hace con valencia –1 (Br –1 ) (el cromo puede tener valencia 2,3,4,5,6 y el bromo puede tener valencia +1, –1, 3, 5, 7)
La fórmula sería Cr +3 Br –1 , intercambiamos las valencias pero poniendo su número como subíndice y queda CrBr 3 (sería Cr 1 , pero el uno no se escribe).
La Unión Internacional de Química Pura y Aplicada (IUPAC) recomienda el uso de la nomenclatura sistemática, la más extendida, y la de Stock o funcional, utilizada sobre todo para nombrar óxidos, hidruros y hidróxidos.
En la nomenclatura sistemática de los óxidos la palabra genérica óxido va precedida de los prefijos griegos mono-, di-, tri-, tetra-, penta-, hexa- o hepta- , según el número de oxígenos que existan; a continuación se indica, de la misma forma, la proporción del segundo elemento.
Por ejemplo, N 2 O 5 , pentaóxido de dinitrógeno (5 átomos de oxígeno y 2 átomos de nitrógeno).
En algunas ocasiones se puede prescindir del prefijo mono- (CaO, óxido de calcio).
En la nomenclatura de Stock no se utilizan prefijos. Los óxidos se nombran con la palabra óxido seguida del nombre del otro elemento y su valencia entre paréntesis; siguiendo con el ejemplo: N 2 O 5 , sería óxido de nitrógeno (V) . Si el elemento que se combina con el oxígeno tiene valencia única, no es necesario indicarla; así, Li 2 O es óxido de litio (de la misma fórmula deducimos que la valencia del litio es 1 y la del oxígeno 2).
En los hidruros metálicos el hidrógeno actúa con valencia –1 y se nombran con la palabra genérica hidruro seguida del nombre del metal. El número de átomos de hidrógeno se indica mediante prefijos numerales; por ejemplo, AuH 3 , trihidruro de oro.
En la nomenclatura funcional se nombran con la palabra hidruro seguida del nombre del metal y su valencia correspondiente, salvo que la valencia sea única [AuH 3 , hidruro de oro (III)] .
En los hidruros no metálicos el hidrógeno actúa con valencia +1 y los no metales con sus respectivas valencias negativas; se nombran añadiendo el sufijo -uro al no metal. Por ejemplo, HCl, cloruro de hidrógeno .
Los hidróxidos se nombran con la palabra hidróxido seguida del nombre del metal, indicando con prefijos numerales sus proporciones; por ejemplo, Mg(OH) 2 , dihidróxido de magnesio.
En la nomenclatura de Stock no se utilizan los prefijos: al nombre del metal se le añade su valencia, aunque ésta se omite cuando es única; por ejemplo, Mg(OH) 2 , hidróxido de magnesio.
En la nomenclatura sistemática, los ácidos oxoácidos se nombran como compuestos binarios en los que el constituyente negativo (anión) es poliatómico; se utiliza el sufijo -ato para el anión y se especifica la valencia del elemento central mediante números romanos entre paréntesis, seguida de la palabra hidrógeno ; por ejemplo, HClO, oxoclorato (I) de hidrógeno . Para estos ácidos, la IUPAC admite la nomenclatura tradicional (HClO, ácido hipocloroso).
- Tabla Periódica: La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones), por su configuración de electrones y sus propiedades químicas. Este ordenamiento muestra tendencias periódicas, como elementos con comportamiento similar en la misma columna.
Las filas de la tabla se denominan períodos y las columnas grupos. Algunos grupos tienen nombres. Así por ejemplo el grupo 17 es el de los halógenos y el grupo 18 el de los gases nobles. La tabla también se divide en cuatro bloques con algunas propiedades químicas similares. Debido a que las posiciones están ordenadas, se puede utilizar la tabla para obtener relaciones entre las propiedades de los elementos, o pronosticar propiedades de elementos nuevos todavía no descubiertos o sintetizados. La tabla periódica proporciona un marco útil para analizar el comportamiento químico y es ampliamente utilizada en química y otras ciencias.